转自:ACROBiosystems官方
ACRO
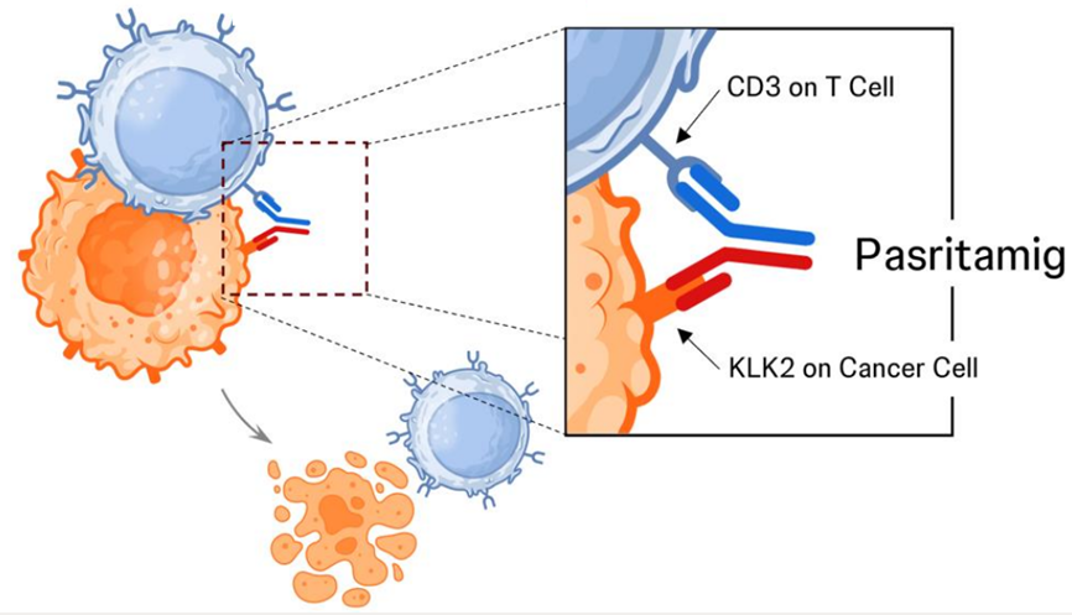
强生KLK2靶向TCE疗法闪耀ASCO2025,前列腺癌治疗添新希望
ASCO2025上,强生公布了其首创性靶向KLK2TCE药物在转移性去势抵抗性前列腺癌(mCRPC)中的数据。结果显示出良好的安全性和初步疗效:42.4%的患者实现了PSA大幅下降(>50%),且安全性良好,未报告ICANS病例。强生3期试验已提上日程。
ACRO
靶点生物学特性:从分泌蛋白到膜锚定新认知
KLK2(Kallikrein,人激肽释放酶2)作为前列腺癌特异性靶点的科学价值源于其独特的生物学特性。研究证实KLK2在局限性前列腺癌(LPC)、转移性激素敏感性前列腺癌(mHSPC)及转移性去势抵抗性前列腺癌(mCRPC)中的阳性率分别达91%、81%和76%,显著高于传统标志物PSMA(分别为78%、64%、54%)。其表达具有严格的前列腺组织特异性,正常组织(如唾液腺、肾脏)几乎无信号,极大降低了脱靶风险。
传统认知中KLK2被归类为分泌蛋白,但Shen研究团队系统性研究了KLK2在前列腺癌不同阶段的表达特征,通过流式细胞术和共聚焦显微镜成像发现,其在VCaP细胞系及患者来源的mCRPC样本中均稳定锚定于细胞膜表面,可能与糖基磷脂酰肌醇(GPI)修饰相关。这一发现颠覆了既往认知,为膜结合型双抗(TCE)和放射性配体疗法(RLT)的开发奠定了基础。

ACRO
KLK2靶点潜力凸显,多维度疗法布局加速
双抗设计革新:平衡疗效与安全性
强生开发的KLK2×CD3双抗Pasritamig(JNJ-78278343)采用Zymeworks的Azymetric™平台构建,通过亲和力差异化设计(KLK2端KD=10nM,CD3端KD=100nM)精准调控T细胞激活强度。此次强生公布的Pasritamig(KLK2靶向TCE)公布的积极数据初步验证了其临床潜力。临床数据显示,该药物在最高2000mg剂量下,细胞因子释放综合征(CRS)发生率仅4.6%(均为1-2级),静脉给药免疫原性(ADA15.4%)显著低于皮下给药(48%)。
除了开发双特异性抗体外,围绕KLK2的创新疗法布局已延伸至α放射性配体疗法及CAR-T细胞疗法等多领域,有望突破现有PSMA靶向疗法的耐药瓶颈,并与PSMA疗法形成互补,大幅拓宽前列腺癌患者的受益范围。
放射性配体疗法:α粒子精准杀伤
Shen研究团队还开发了三种不同机制的靶向KLK2的疗法(双特异T细胞重定向、放射性配体和CAR-T细胞疗法),展示了他们在体外和体内模型中的预临床效果。放射性配体疗法JNJ-6420(225Ac标记抗KLK2抗体)通过靶向膜结合型KLK2,利用α粒子的高线性能量传递特性诱导DNA双链断裂。Ⅰ期研究显示,500nCi剂量组肿瘤体积缩小78%,放射性主要富集于肿瘤组织,但需警惕血小板减少和间质性肺病风险。
CAR-T细胞疗法:实体瘤领域的突破性尝试
自体KLK2CAR-T细胞在Ⅰ期试验中实现7/10例完全缓解,且无脱靶毒性。外周血CAR-T扩增峰值达输注量的30倍,初步验证了靶向实体瘤的可行性。
结语
KLK2靶向疗法有望与PSMA-RLT形成互补(如强生PSMA/KLK2双靶点CAR-T计划),覆盖多线治疗耐药患者。值得关注的是,岸迈生物与JuriBiosciences达成2.1亿美元授权协议(含4000万美元预付款),共同推进KLK2TCE疗法开发,这一交易进一步印证了KLK2靶点的临床价值与商业潜力。
ACROBiosystemsKLK2产品提供关键支持
为加速KLK2相关药物的研发进程,ACROBiosystems百普塞斯针对性开发了系列KLK2产品,特征如下:
★高纯度:经SDS-PAGE验证纯度超90%
★高酶活:酶活被纳入常规QC检测项,数据稳定可靠
★质量一致性:稳定保障研发过程中的质量一致性,为药物研发提供可靠支撑
验证数据
✍超95%纯度经SDS-PAGE验证
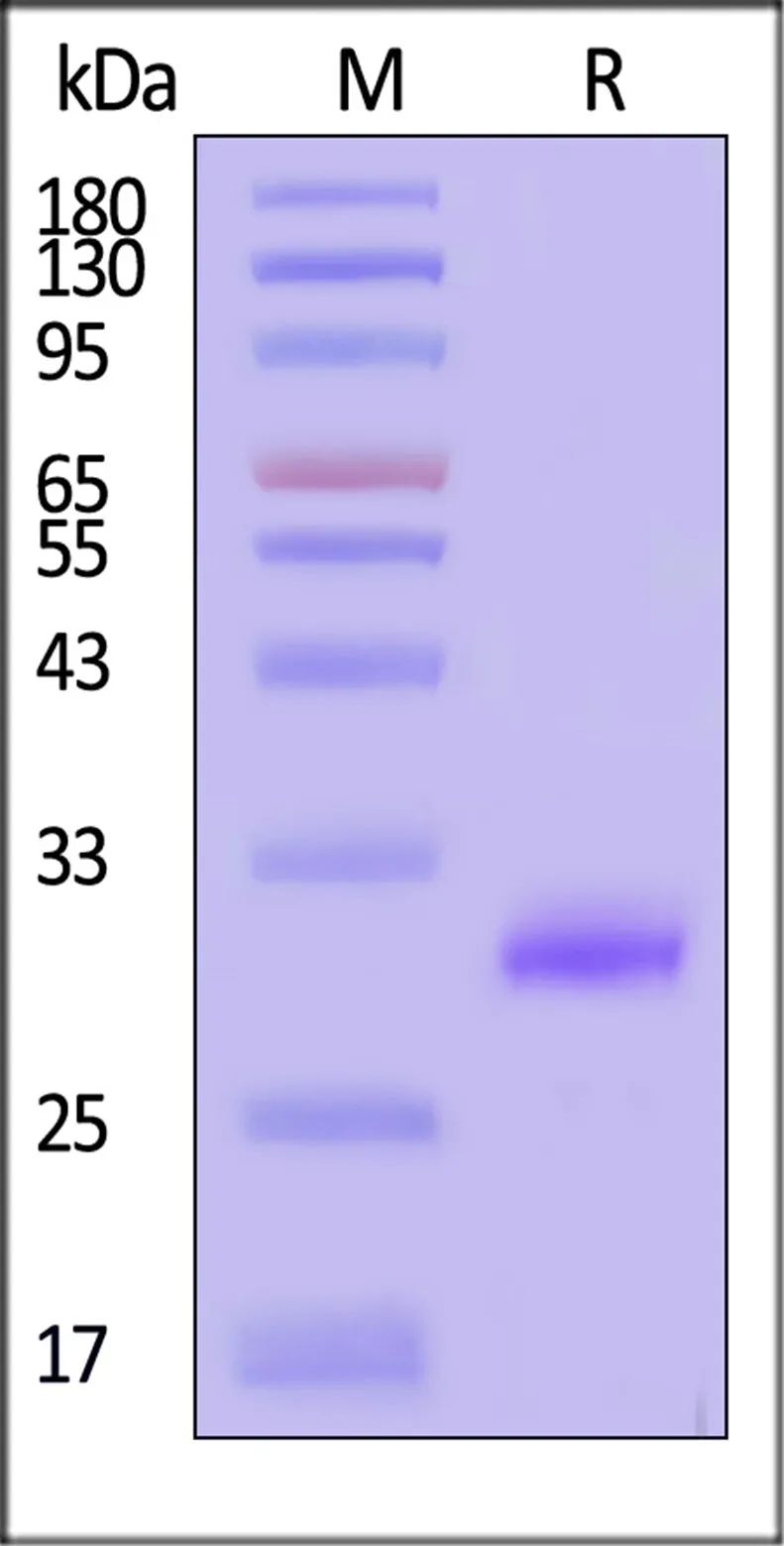
onSDS-PAGEunderreducing(R)condition.ThegelwasstainedwithCoomassieBlue.Thepurityoftheproteinisgreaterthan95%(WithStarRibbonPre-stainedProteinMarker).
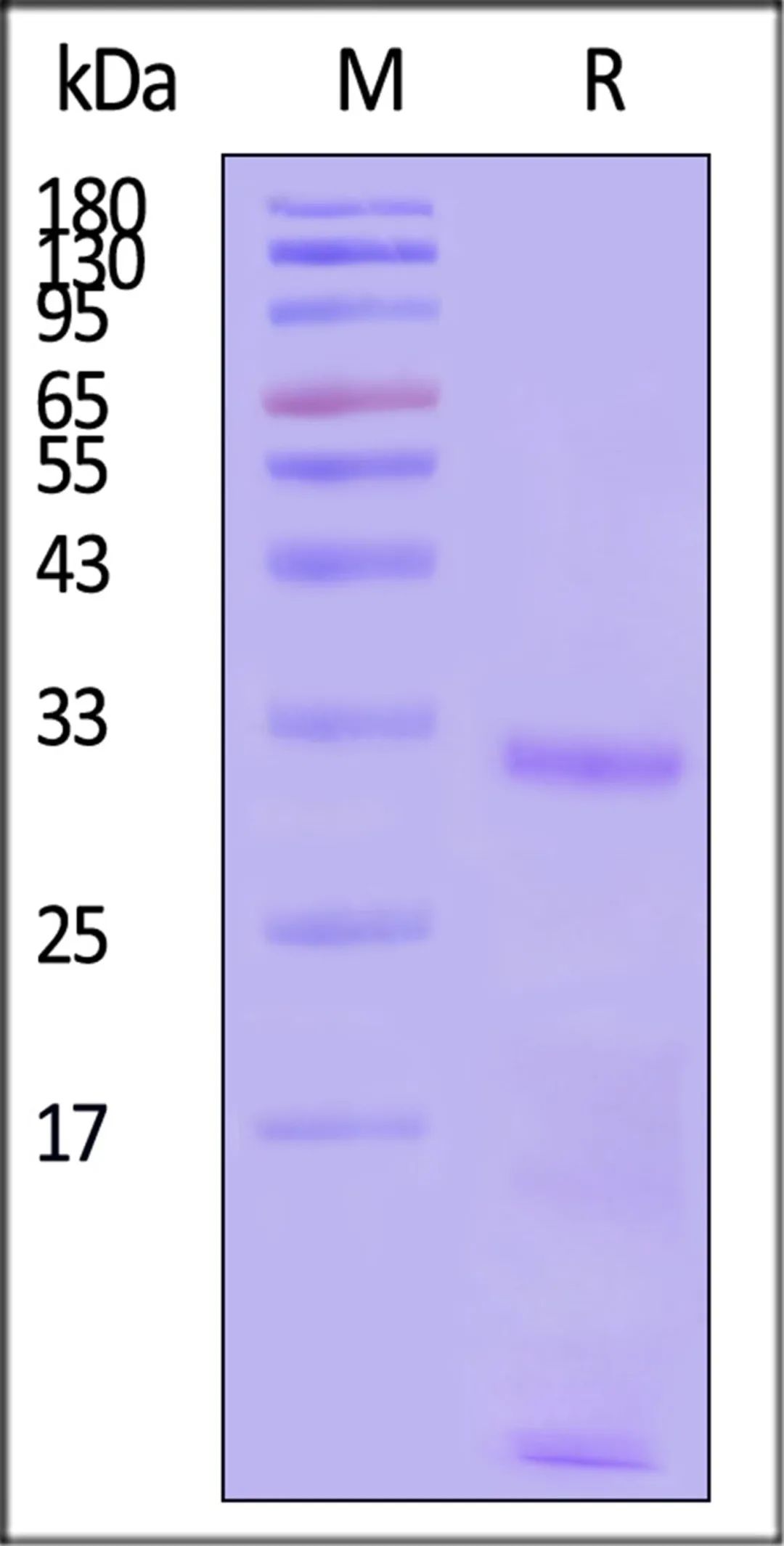
onSDS-PAGEunderreducing(R)condition.ThegelwasstainedwithCoomassieBlue.Thepurityoftheproteinisgreaterthan85%(WithStarRibbonPre-stainedProteinMarker).
✍高酶活
